한국과학기술연구원 연구팀, 크리스퍼 유전자 가위 기술 개량
[더리포트] 악성 종양세포 단백질을 억제하고 면역세포를 활성화 하는 새로운 유전자 가위 기술이 개발되었다. 이는 ‘크리스퍼 가위’를 개량, 외부 전달체가 필요 없는 기술이다.
크리스퍼 유전자 가위 기술은 면역세포의 유전자를 선택적으로 교정함으로써 면역세포가 선택적으로 암세포만을 공격하도록 유도하는 면역 치료 요법으로 최근 각광을 받고 있다.
24일 한국과학기술연구원(KIST, 원장 이병권)에 따르면 이 같은 사실은 테라그노시스연구단 장미희 박사팀이 세종대학교(총장 배덕효) 홍석만 교수팀과 공동연구를 통해 밝혀졌다.
유전자 가위 기술은 특정 유전자를 제거하거나 정상적인 기능을 하도록 유전자를 편집함으로써, 질병의 근본적인 원인을 제거하는 기술이다.
KIST 장미희 박사는 앞서 크리스퍼 유전자 가위를 외부 전달체 없이도 스스로 세포막을 뚫고 들어갈 수 있게 개량한 바 있다. 그러나 면역 활성을 조절하는 유전자의 종류가 다양할 뿐더러, 안전하면서도 간편하게 면역 치료를 유도하는 기술은 아직 부족한 실정이었다.
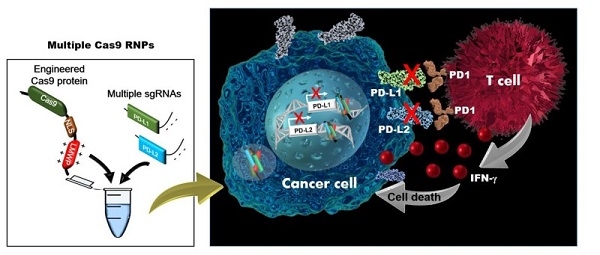
이번 공동 연구진은 외부 전달체 없이 혈액암세포로 유전자를 전달할 수 있으면서도 여러 유전자를 동시에 효율적으로 교정할 수 있도록 크리스퍼 유전자 가위를 한 번 더 개량한 것이다.
기존의 유전자 가위 기술을 이용한 방법으로는 면역세포 중 ‘T 세포’와 같은 혈액암 세포 내에 유전자를 전달하는 방식으로 주로 바이러스나 전기 충격 요법을 사용하였다. 바이러스를 이용한 방식은 원치 않은 면역 반응을 유도하는 경우가 많고 표적이 아닌 게놈 서열에 유전자가 잘못 삽입되어질 가능성이 높다.
또한 전기 충격 방식은 별도의 고가 장비가 필요하며, 전기 자극으로 대량의 세포를 한 번에 교정하기가 어렵고 세포생존도(cell viability)도 낮다는 단점을 가지고 있다.
KIST-세종대학교 공동연구진이 개발한 이번 기술은 면역체계를 억제하는 것으로 알려진 면역 체크포인트(암세포의 파괴를 방해하는 단백질) 유전자 중 ‘PD-L1’, ‘PD-L2’ 두 개를 동시에 표적으로 한다.
이 면역 체크포인트를 표적으로 하여 면역 체계를 방해하지 못하게 유도하고, 결국 세포독성 T 세포가 암을 직접 공격할 수 있도록 하여 항암 면역 반응을 증가시키는 치료 효능을 확인하였다.
장미희 박사는 “새롭게 개발된 유전자 가위 기술은 다양한 면역세포에 적용가능하기 때문에, 암 뿐만 아니라 자가면역 질환, 염증성 질환 등 다양한 질병 치료제 개발에 적용이 가능할 것으로 기대된다”고 밝혔다.
이번 연구결과는 ‘Biomaterials’ (IF : 10.273, JCR 상위분야 : 1.56%)에 최신호에 게재되었다.
